Mængdeberegning[]
Mængdeberegning bruges i næsten alle aspekter i kemi.
Mol[]
Mol bliver betegnet med enheden: mol. I mængdeberegnings-trekanterne bliver mol betegnet som n. Man bruger mol når man regner med molekyler og atomer. Molekyler og atomer er meget små af størrelse og er derfor næsten umulige at tælle, derfor har man valgt at bruge enheden mol. En mol er lig 6,02*1023[1] også kaldet Avagadros konstant, dette bruges til at forklare vægten af atomkerne, f.eks:
Kalium har en molarmasse på 39,1 gram/mol. Dette betyder at en mol af Kalium atomer, vejer 39,1 gram.
Massen[]
Massen er betegnelsen for vægten. Når man snakker om massen måles det i gram, f.eks:
1 gram Kalium indeholder 0,025 mol. Dette betyder at der er 0,025*(6,02*1023) atomer pr. 1 gram Kalium
Molarmasse[]
Molarmassen er betegnelsen for stoffets vægt. Man kan udregne Molarmassen hvis man tager Molvægten af alle Grundstofferne i forbindelse, f.eks:
H2O indeholder 3 atom kerner. 2 brint og en oxygen. Brint har en molarmasse på 1,00786 g/mol[2] og Oxygen har en molarmasse på 15,999 g/mol[3]. Dette betyder at H2O har en molar vægt på 18,013 g/mol.
Andre ord for Molarmassen er også Molvægt, Molmasse Og Molærmasse. Molarmassen har SI enheden g/mol og går under benævnelsen M. f
Volumen[]
Volumen er betegnelsen for rumfanget, som et stof fylder, dette angives med enheden L (liter), dette kan bruges, sammen med koncentrationen (Molær) c (mol/L) til at finde mol. F.eks:
1 liter 0.1 Molær HCl indeholder 0.1 mol
Koncentrationen[]
Koncentrationen er forholdet mellem antal mol i af et stof i en blanding, og volumen af den samlede blanding. Altså koncentrationen af et stof i en blanding. f.eks:
1 liter vand og 0.1 liter HCl, og du får at vide at du har 0.1 mol HCl. Dette betyder at koncentrationen af HCl bliver 0.091 mol/L.
Udregninger[]
Når man arbejder med mængdeberegninger bruger man 2 forskellige trekanter. Den første hedder Mol-trekanten og den næste hedder, koncentrations-trekanten.

Mol-trekanten
Måden disse trekanter skal udregnes er således. Den vandrette streg skal tolkes som en brøkstreg dvs.
m(g) / Mw(g/mol) = n(mol)
Den lodrette streg skal tolkes som et gange tegn dvs.
c(mol/L=M) * V(L) = n(mol)
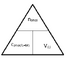
Koncentrationstrekanten
Enheder & Benævnelse[]
understregning indikere det teknisk-korrekte term.
|
Navn |
Benævnelse |
Enhed |
|---|---|---|
|
Stofmængde |
n |
mol |
|
Molarmasse |
M |
g/mol |
|
Massen |
m |
g |
|
Volumen Rumfang |
V |
L |
|
Koncentrationen |
C |
mol/L |
Benævnelser bliver brugt før lighedstegnet (=)
Enheder bliver brugt efter lighedstegnet (=)
Kilder: Husk at være kildekritisk overfor disse kilder.
Set af KTL